铷(Rb)
铷(Rb)元素详细资料
元素 名称 |
|
||||||||||||||
原 子 结 构 |
|
电子模型 | 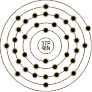 |
||||||||||||
发 现 |
1861年, 由 R.W. Bunsen 和 G. Kirchoff (德国,海德尔堡大学)发现。 | ||||||||||||||
来 源 |
很丰富,但较分散,生产也受到限制,一般由生产锂的过程中产生。 | ||||||||||||||
用 途 |
用作催化剂,光电池等。 | ||||||||||||||
物 理 性 质 |
|
||||||||||||||
化 学 性 质 |
|||||||||||||||
地 质 数 据 |
|
||||||||||||||
生 物 数 据 |
|
||||||||||||||
关于元素周期表
元素周期表是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首创的,后来又经过多名科学家多年的修订才形成当代的周期表。
元素周期表中共有118种元素。每一种元素都有一个编号,大小恰好等于该元素原子的核内电子数目,这个编号称为原子序数。
原子的核外电子排布和性质有明显的规律性,科学家们是按原子序数递增排列,将电子层数相同的元素放在同一行,将最外层电子数相同的元素放在同一列。
元素周期表有7个周期,16个族。每一个横行叫作一个周期,每一个纵行叫作一个族。这7个周期又可分成短周期(1、2、3)、长周期(4、5、6)和不完全周期(7)。共有16个族,又分为7个主族(ⅠA-ⅦA),7个副族(ⅠB-ⅦB),一个第ⅧB族,一个零族。
元素在周期表中的位置不仅反映了元素的原子结构,也显示了元素性质的递变规律和元素之间的内在联系。
同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增,原子半径递减(零族元素除外)。失电子能力逐渐减弱,获电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。元素的最高正氧化数从左到右递增(没有正价的除外),最低负氧化数从左到右递增(第一周期除外,第二周期的O、F元素除外)。
同一族中,由上而下,最外层电子数相同,核外电子层数逐渐增多,原子序数递增,元素金属性递增,非金属性递减。
元素周期表的意义重大,科学家正是用此来寻找新型元素及化合物。
元素周期表中共有118种元素。每一种元素都有一个编号,大小恰好等于该元素原子的核内电子数目,这个编号称为原子序数。
原子的核外电子排布和性质有明显的规律性,科学家们是按原子序数递增排列,将电子层数相同的元素放在同一行,将最外层电子数相同的元素放在同一列。
元素周期表有7个周期,16个族。每一个横行叫作一个周期,每一个纵行叫作一个族。这7个周期又可分成短周期(1、2、3)、长周期(4、5、6)和不完全周期(7)。共有16个族,又分为7个主族(ⅠA-ⅦA),7个副族(ⅠB-ⅦB),一个第ⅧB族,一个零族。
元素在周期表中的位置不仅反映了元素的原子结构,也显示了元素性质的递变规律和元素之间的内在联系。
同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增,原子半径递减(零族元素除外)。失电子能力逐渐减弱,获电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。元素的最高正氧化数从左到右递增(没有正价的除外),最低负氧化数从左到右递增(第一周期除外,第二周期的O、F元素除外)。
同一族中,由上而下,最外层电子数相同,核外电子层数逐渐增多,原子序数递增,元素金属性递增,非金属性递减。
元素周期表的意义重大,科学家正是用此来寻找新型元素及化合物。
